தனிமங்களின் ஆக்சிசனேற்ற நிலைகளின் பட்டியல் (list of oxidation states of the elements)
(முழு எண்களாக மட்டுமுள்ளவை) இங்கு தரப்பட்டுள்ளது. மிகப் பொதுவாகக்
காணப்படுபவை தடித்த எழுத்துகளில் தரப்பட்டுள்ளன. நார்மன் கிரன்வுட்,
எர்ன்சாவ்[1] ஆகியோரின் கருத்துகளின் அடிப்படையில் சிலவற்றைக் கூடுதலாகச் சேர்த்து இந்த அட்டவணை பட்டியலிடப்பட்டுள்ளது. ஆக்சிசனேற்ற நிலை 0 எல்லாத் தனிமங்களுக்கும் பொதுவானது என்பதால் அது தனிமங்களின் குறியீடு உள்ள வரிசையிலேயே கொடுக்கப்பட்டுள்ளது. 1889 ஆம் ஆண்டில் மெண்டெலீவ் இந்த அட்டவணையின் மாதிரியை வடிவமைத்தார். தனிமங்களுடைய ஆக்சிசனேற்ற நிலைகளின் ஆவர்த்தனப் பண்பு இவ்வட்டவணையில் வெளிப்படுகிறது[1].
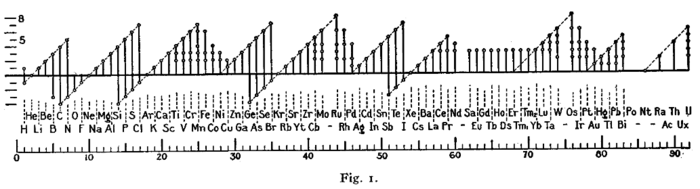
இதே போன்ற ஒரு வடிவப் படம் (கீழே கொடுக்கப்பட்டுள்ளது) 1919 ஆம் ஆண்டில்
இர்விங் இலேங்முர் என்ற அமெரிக்க வேதியியலாளரால் பயன்படுத்தப்பட்டது[99].
தொடக்கக் காலத்தில் வெளியிடப்பட்ட எண்ம விதியின் கூறுகள் ஆக்சிசனேற்ற
எண்களின் ஆவர்த்தனப் பண்புகளுடன் பொருந்தியதால் இவ்விதியை அவர்
ஏற்றுக்கொண்டார்.
பட்டியல்
தனிமம்
அருமன் வாயு
| Z | தனிமம் | எதிர் ஆக்சிசனேற்ற நிலைகள் |
நேர் ஆக்சிசனேற்ற நிலைகள் |
குழு | குறிப்புகள் | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| −5 | −4 | −3 | −2 | −1 | 0 | +1 | +2 | +3 | +4 | +5 | +6 | +7 | +8 | +9 | ||||
| 1 | நீரியம் | −1 | H | +1 | 1 | |||||||||||||
| 2 | ஈலியம் | He | 18 | |||||||||||||||
| 3 | இலித்தியம் | Li | +1 | 1 | [2] | |||||||||||||
| 4 | பெரிலியம் | Be | +1 | +2 | 2 | [3] | ||||||||||||
| 5 | போரான் | −5 | −1 | B | +1 | +2 | +3 | 13 | [4][5] | |||||||||
| 6 | கரிமம் | −4 | −3 | −2 | −1 | C | +1 | +2 | +3 | +4 | 14 | |||||||
| 7 | நைட்ரசன் | −3 | −2 | −1 | N | +1 | +2 | +3 | +4 | +5 | 15 | |||||||
| 8 | ஆக்சிசன் | −2 | −1 | O | +1 | +2 | 16 | |||||||||||
| 9 | புளோரின் | −1 | F | 17 | ||||||||||||||
| 10 | நியான் | Ne | 18 | |||||||||||||||
| 11 | சோடியம் | −1 | Na | +1 | 1 | [2] | ||||||||||||
| 12 | மக்னீசியம் | Mg | +1 | +2 | 2 | [6] | ||||||||||||
| 13 | அலுமினியம் | −2 | −1 | Al | +1 | +2 | +3 | 13 | [7][8][9] | |||||||||
| 14 | சிலிக்கான் | −4 | −3 | −2 | −1 | Si | +1 | +2 | +3 | +4 | 14 | |||||||
| 15 | பாசுபரசு | −3 | −2 | −1 | P | +1 | +2 | +3 | +4 | +5 | 15 | |||||||
| 16 | கந்தகம் | −2 | −1 | S | +1 | +2 | +3 | +4 | +5 | +6 | 16 | |||||||
| 17 | குளோரின் | −1 | Cl | +1 | +2 | +3 | +4 | +5 | +6 | +7 | 17 | [10] | ||||||
| 18 | ஆர்கான் | Ar | 18 | |||||||||||||||
| 19 | பொட்டாசியம் | −1 | K | +1 | 1 | [2] | ||||||||||||
| 20 | கல்சியம் | −1 | Ca | +1 | +2 | 2 | [11][12] | |||||||||||
| 21 | இசுக்காண்டியம் | Sc | +1 | +2 | +3 | 3 | ||||||||||||
| 22 | தைட்டானியம் | −2 | −1 | Ti | +1 | +2 | +3 | +4 | 4 | [13][14][15] | ||||||||
| 23 | வனேடியம் | −3 | −1 | V | +1 | +2 | +3 | +4 | +5 | 5 | [14] | |||||||
| 24 | குரோமியம் | −4 | −2 | −1 | Cr | +1 | +2 | +3 | +4 | +5 | +6 | 6 | [14] | |||||
| 25 | மாங்கனீசு | −3 | −2 | −1 | Mn | +1 | +2 | +3 | +4 | +5 | +6 | +7 | 7 | |||||
| 26 | இரும்பு | −4 | −2 | −1 | Fe | +1 | +2 | +3 | +4 | +5 | +6 | 8 | [16][17] | |||||
| 27 | கோபால்ட் | −3 | −1 | Co | +1 | +2 | +3 | +4 | +5 | 9 | [14] | |||||||
| 28 | நிக்கல் | −2 | −1 | Ni | +1 | +2 | +3 | +4 | 10 | [18] | ||||||||
| 29 | செப்பு | −2 | Cu | +1 | +2 | +3 | +4 | 11 | [17] | |||||||||
| 30 | துத்தநாகம் | −2 | Zn | +1 | +2 | 12 | [17][19] | |||||||||||
| 31 | காலியம் | −5 | −4 | −2 | −1 | Ga | +1 | +2 | +3 | 13 | [8][20] | |||||||
| 32 | ஜேர்மானியம் | −4 | −3 | −2 | −1 | Ge | +1 | +2 | +3 | +4 | 14 | [21] | ||||||
| 33 | ஆர்சனிக் | −3 | −2 | −1 | As | +1 | +2 | +3 | +4 | +5 | 15 | [8][22][23] | ||||||
| 34 | செலீனியம் | −2 | −1 | Se | +1 | +2 | +3 | +4 | +5 | +6 | 16 | [24][25][26][27] | ||||||
| 35 | புரோமின் | −1 | Br | +1 | +3 | +4 | +5 | +7 | 17 | |||||||||
| 36 | கிரிப்டான் | Kr | +2 | 18 | ||||||||||||||
| 37 | ருபீடியம் | −1 | Rb | +1 | 1 | [2] | ||||||||||||
| 38 | இசுட்ரோன்சியம் | Sr | +1 | +2 | 2 | [28] | ||||||||||||
| 39 | இட்ரியம் | Y | +1 | +2 | +3 | 3 | [29][30] | |||||||||||
| 40 | சிர்க்கோனியம் | −2 | Zr | +1 | +2 | +3 | +4 | 4 | [14][31] | |||||||||
| 41 | நையோபியம் | −3 | −1 | Nb | +1 | +2 | +3 | +4 | +5 | 5 | [14][32] | |||||||
| 42 | மாலிப்டினம் | −4 | −2 | −1 | Mo | +1 | +2 | +3 | +4 | +5 | +6 | 6 | [14] | |||||
| 43 | டெக்னீசியம் | −3 | −1 | Tc | +1 | +2 | +3 | +4 | +5 | +6 | +7 | 7 | ||||||
| 44 | ருத்தேனியம் | −4 | −2 | Ru | +1 | +2 | +3 | +4 | +5 | +6 | +7 | +8 | 8 | [14][17] | ||||
| 45 | ரோடியம் | −3 | −1 | Rh | +1 | +2 | +3 | +4 | +5 | +6 | 9 | [14] | ||||||
| 46 | பலேடியம் | Pd | +1 | +2 | +3 | +4 | +5 | +6 | 10 | [33][34][35][36] | ||||||||
| 47 | வெள்ளி (தனிமம்) | −2 | −1 | Ag | +1 | +2 | +3 | +4 | 11 | [17][37][38] | ||||||||
| 48 | காட்மியம் | −2 | Cd | +1 | +2 | 12 | [17][39] | |||||||||||
| 49 | இண்டியம் | −5 | −2 | −1 | In | +1 | +2 | +3 | 13 | [8][40][41] | ||||||||
| 50 | வெள்ளீயம் | −4 | −3 | −2 | −1 | Sn | +1 | +2 | +3 | +4 | 14 | [8][42][43] | ||||||
| 51 | அந்திமனி | −3 | −2 | −1 | Sb | +1 | +2 | +3 | +4 | +5 | 15 | [8][44][45][46] | ||||||
| 52 | தெலூரியம் | −2 | −1 | Te | +1 | +2 | +3 | +4 | +5 | +6 | 16 | [8][47][48][49] | ||||||
| 53 | அயோடின் | −1 | I | +1 | +3 | +4 | +5 | +6 | +7 | 17 | [50][51] | |||||||
| 54 | செனான் | Xe | +2 | +4 | +6 | +8 | 18 | [52] | ||||||||||
| 55 | சீசியம் | −1 | Cs | +1 | 1 | [2] | ||||||||||||
| 56 | பேரியம் | Ba | +1 | +2 | 2 | [53] | ||||||||||||
| 57 | இலந்தனம் | La | +1 | +2 | +3 | [54] | ||||||||||||
| 58 | சீரியம் | Ce | +2 | +3 | +4 | |||||||||||||
| 59 | பிரசியோடைமியம் | Pr | +2 | +3 | +4 | |||||||||||||
| 60 | நியோடைமியம் | Nd | +2 | +3 | +4 | [55] | ||||||||||||
| 61 | புரோமித்தியம் | Pm | +2 | +3 | [56] | |||||||||||||
| 62 | சமாரியம் | Sm | +2 | +3 | ||||||||||||||
| 63 | யூரோப்பியம் | Eu | +2 | +3 | ||||||||||||||
| 64 | கடோலினியம் | Gd | +1 | +2 | +3 | |||||||||||||
| 65 | டெர்பியம் | Tb | +1 | +2 | +3 | +4 | [56] | |||||||||||
| 66 | டிசிப்ரோசியம் | Dy | +2 | +3 | +4 | [57] | ||||||||||||
| 67 | ஓல்மியம் | Ho | +2 | +3 | [56] | |||||||||||||
| 68 | எர்பியம் | Er | +2 | +3 | [56] | |||||||||||||
| 69 | தூலியம் | Tm | +2 | +3 | ||||||||||||||
| 70 | இட்டெர்பியம் | Yb | +2 | +3 | ||||||||||||||
| 71 | லியுதேத்தியம் | Lu | +2 | +3 | 3 | [56] | ||||||||||||
| 72 | ஆஃபினியம் | −2 | Hf | +1 | +2 | +3 | +4 | 4 | [14][58] | |||||||||
| 73 | டாண்ட்டலம் | −3 | −1 | Ta | +1 | +2 | +3 | +4 | +5 | 5 | [14][59] | |||||||
| 74 | தங்குதன் | −4 | −2 | −1 | W | +1 | +2 | +3 | +4 | +5 | +6 | 6 | [14] | |||||
| 75 | இரேனியம் | −3 | −1 | Re | +1 | +2 | +3 | +4 | +5 | +6 | +7 | 7 | ||||||
| 76 | ஓசுமியம் | −4 | −2 | −1 | Os | +1 | +2 | +3 | +4 | +5 | +6 | +7 | +8 | 8 | [17][60] | |||
| 77 | இரிடியம் | −3 | −1 | Ir | +1 | +2 | +3 | +4 | +5 | +6 | +7 | +8 | +9 | 9 | [61][62][63][64] | |||
| 78 | பிளாட்டினம் | −3 | −2 | −1 | Pt | +1 | +2 | +3 | +4 | +5 | +6 | 10 | [17][65][66] | |||||
| 79 | தங்கம் | −3 | −2 | −1 | Au | +1 | +2 | +3 | +5 | 11 | [17] | |||||||
| 80 | mercury | −2 | Hg | +1 | +2 | +4 | 12 | [17][67] | ||||||||||
| 81 | தாலியம் | −5 | −2 | −1 | Tl | +1 | +2 | +3 | 13 | [8][68][69][70] | ||||||||
| 82 | ஈயம் | −4 | −2 | −1 | Pb | +1 | +2 | +3 | +4 | 14 | [8][71][72] | |||||||
| 83 | பிசுமத் | −3 | −2 | −1 | Bi | +1 | +2 | +3 | +4 | +5 | 15 | [73][74][75][76] | ||||||
| 84 | பொலோனியம் | −2 | Po | +2 | +4 | +5 | +6 | 16 | [77] | |||||||||
| 85 | அசுட்டட்டைன் | −1 | At | +1 | +3 | +5 | +7 | 17 | ||||||||||
| 86 | ரேடான் | Rn | +2 | +6 | 18 | [78][79][80] | ||||||||||||
| 87 | பிரான்சீயம் | Fr | +1 | 1 | ||||||||||||||
| 88 | ரேடியம் | Ra | +2 | 2 | ||||||||||||||
| 89 | ஆக்டினியம் | Ac | +2 | +3 | [81] | |||||||||||||
| 90 | தோரியம் | Th | +1 | +2 | +3 | +4 | [82] | |||||||||||
| 91 | புரோடாக்டினியம் | Pa | +2 | +3 | +4 | +5 | [83] | |||||||||||
| 92 | யுரேனியம் | U | +1 | +2 | +3 | +4 | +5 | +6 | [84][85] | |||||||||
| 93 | நெப்டியூனியம் | Np | +2 | +3 | +4 | +5 | +6 | +7 | [86] | |||||||||
| 94 | புளுட்டோனியம் | Pu | +1 | +2 | +3 | +4 | +5 | +6 | +7 | +8 | [86][87][88] | |||||||
| 95 | அமெரிசியம் | Am | +2 | +3 | +4 | +5 | +6 | +7 | +8 | [89][90] | ||||||||
| 96 | கியூரியம் | Cm | +2 | +3 | +4 | +6 | [86][91][92] | |||||||||||
| 97 | பெர்க்கிலியம் | Bk | +2 | +3 | +4 | [93] | ||||||||||||
| 98 | கலிபோர்னியம் | Cf | +2 | +3 | +4 | |||||||||||||
| 99 | ஐன்ஸ்டைனியம் | Es | +2 | +3 | +4 | [94] | ||||||||||||
| 100 | பெர்மியம் | Fm | +2 | +3 | ||||||||||||||
| 101 | மெண்டலீவியம் | Md | +2 | +3 | ||||||||||||||
| 102 | நொபிலியம் | No | +2 | +3 | ||||||||||||||
| 103 | இலாரென்சியம் | Lr | +3 | 3 | ||||||||||||||
| 104 | இரதர்ஃபோர்டியம் | Rf | +4 | 4 | ||||||||||||||
| 105 | தூப்னியம் | Db | +5 | 5 | [95] | |||||||||||||
| 106 | சீபோர்கியம் | Sg | +6 | 6 | [96] | |||||||||||||
| 107 | போரியம் | Bh | +7 | 7 | [97] | |||||||||||||
| 108 | ஆசியம் | Hs | +8 | 8 | [98] | |||||||||||||
No comments:
Post a Comment